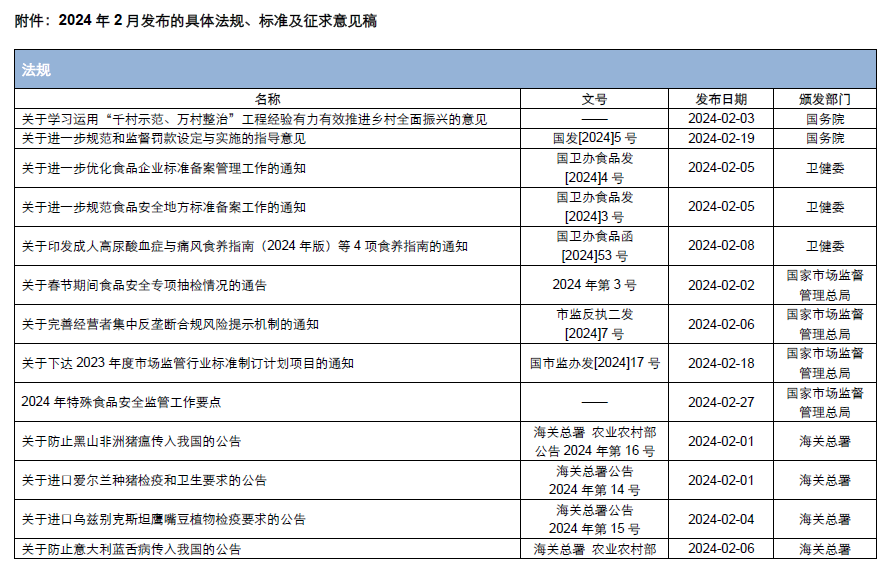
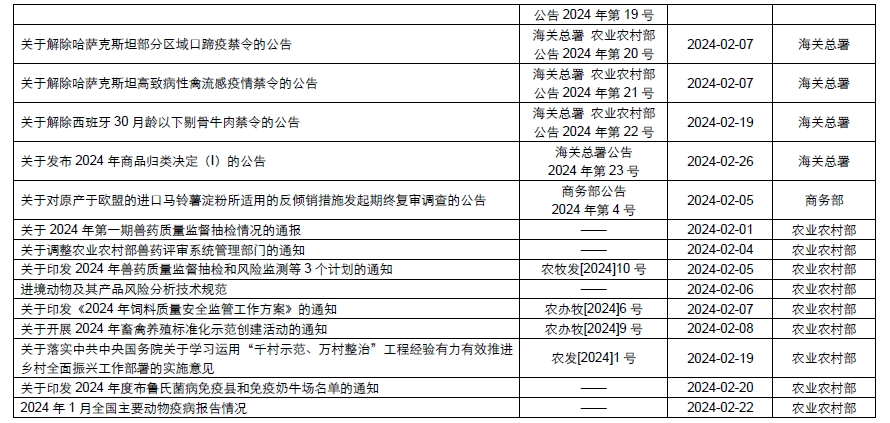
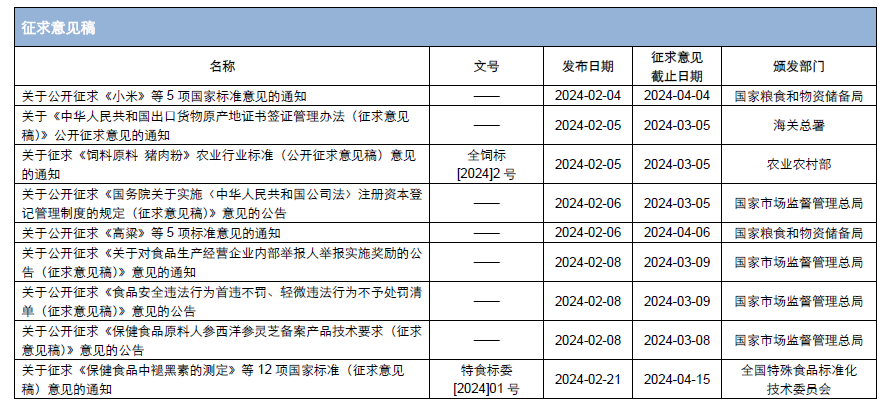
本月,各政府監管機構陸續發布了一(yī)些食品相關的重要法規标準、征求意見稿及公告。其中(zhōng),國家市場監督管理總局發布《2024年特殊食品安全監管工(gōng)作要點》,對《保健食品原料 人參 西洋參 靈芝備案産品技術要求(征求意見稿)》和《食品安全違法行爲首違不罰、輕微違法行爲不予處罰清單(征求意見稿)》公開(kāi)征求意見;全國特殊食品标準化技術委員(yuán)會對《保健食品中(zhōng)褪黑素的測定》等12項國家标準(征求意見稿)公開(kāi)征求意見。
爲了更好地幫助企業落地法規,医脉经纬(北京)管理咨询有限公司對2024年2月份發布的重點法規、标準以及征求意見稿進行了簡單解讀,同時對本月發布的食品相關法規、标準等進行了彙總,供大(dà)家參考。
一(yī)、2024年特殊食品安全監管工(gōng)作要點發布
國家市場監督管理總局近日發布了《2024年特殊食品安全監管工(gōng)作要點》(以下(xià)簡稱《工(gōng)作要點》)。從制度機制、責任落實、風險防控、監管保障等方面對特殊食品的監管工(gōng)作提出要求。《工(gōng)作要點》指出,2024年将推進嬰幼兒配方液态奶納入注冊管理相關修法進程,制訂該類産品的生(shēng)産許可審查細則;持續完善保健食品原料目錄,研究新增允許保健食品聲稱的保健功能目錄,發布“無産品技術要求、無有效期”保健食品換證審查要點,鼓勵保健食品新功能的研發申請,持續推動國産保健食品備案“跨省通辦”;推進制修訂特殊醫學用途配方食品臨床試驗相關規定。
《工(gōng)作要點》爲特殊食品生(shēng)産經營企業和監管機構明确了監管工(gōng)作重點,相關組織機構也可從《工(gōng)作要點》中(zhōng)了解特殊食品監管制度和發展方向方面的趨勢。
二、《保健食品原料人參 西洋參 靈芝備案産品技術要求(征求意見稿)》、保健食品中(zhōng)褪黑素的測定》等12項國家标準(征求意見稿)公開(kāi)征求意見
繼2023年12月18日總局發布《保健食品原料目錄 人參》、《保健食品原料目錄 西洋參》、《保健食品原料目錄 靈芝》,對這3種保健食品原料的用量範圍、适宜人群、不适宜人群、功效、注意事項做出明确規定之後,2024年2月8日,總局發布了《保健食品原料人參 西洋參 靈芝備案産品技術要求(征求意見稿)》,對使用上述3種保健食品原料備案的産品技術要求公開(kāi)征求意見。技術要求中(zhōng)明确了備案時輔料的使用要求、劑型要求、生(shēng)産工(gōng)藝要求、産品技術要求和其他要求。至此,人參、西洋參、靈芝這3種保健食品原料備案要求相關法規已齊全。征求意見落地之後,企業可以對以這3種原料制得的保健食品實施備案。征求意見反饋截止至2024年3月8日。
爲完善保健食品的檢測管理,全國特殊食品标準化技術委員(yuán)會發布了《關于征求<保健食品中(zhōng)褪黑素的測定>等12項國家标準(征求意見稿)意見的通知(zhī)》,對保健食品中(zhōng)的葛根素、輔酶Q10、泛酸、褪黑素、硫胺素、核黃素、吡哆醇、煙酸、煙酰胺、咖啡因、脫氫表雄甾酮(DHEA)、番茄紅素、淫羊藿苷、綠原酸、肌醇、吡啶甲酸鉻、甘草酸明确規定了檢測方法,爲企業及檢測機構實施保健食品的檢測提供了依據。
三、《食品安全違法行爲首違不罰、輕微違法行爲不予處罰清單(征求意見稿)》公開(kāi)征求意見
2024年2月8日,總局發布《食品安全違法行爲首違不罰清單(征求意見稿)》(以下(xià)簡稱《首違不罰清單》)和《食品安全輕微違法行爲不予處罰清單(征求意見稿)》。在《首違不罰清單》中(zhōng),總局對“首次違法”給出明确定義,即經營主體(tǐ)第一(yī)次違反法律、法規、規章等規定,依法被判定爲違法行爲的情況。同一(yī)經營主體(tǐ)兩年内未發生(shēng)同類違法行爲的,視爲首次違法。清單内詳細列明了8個類型的違法行爲,爲判定違法行爲是否屬于同一(yī)類型提供了依據。
上述兩個清單均明确了違法行爲的類型、不同類型違法行爲的處罰依據、免罰條件和不适用清單的機構,并明确說明隻有清單中(zhōng)列出的免罰條件同時滿足時,才适用清單規定的不予處罰情形。征求意見反饋截止至2024年3月9日。
医脉经纬(北京)管理咨询有限公司希望通過對二月法規回顧以及重點法規的解讀,對企業及行業人員(yuán)把握監管變化趨勢、合規宣傳産品有所幫助。医脉经纬(北京)管理咨询有限公司可提供标準法規咨詢、行業輿情監控、食品标簽審核等咨詢服務,有任何問題歡迎随時聯系我(wǒ)們(010-51301566)。
 京公網安備11010502045875
京公網安備11010502045875