
自2024年1月起,由國家市場監督管理總局、海關總署及農業農村(cūn)部發布的多項法規、标準即将實施。其中(zhōng),國家市場監督管理總局發布的《特殊醫學用途配方食品注冊管理辦法》,于2024年1月1日正式實施。爲了更好的幫助企業了解重要法規情況,医脉经纬(北京)管理咨询有限公司對相關内容進行了簡單解讀,供大(dà)家參考。
2023年11月28日國家市場監督管理總局修訂發布了《特殊醫學用途配方食品注冊管理辦法》(以下(xià)稱《辦法》)。進一(yī)步完善特殊醫學用途配方食品(以下(xià)簡稱“特醫食品”)注冊管理要求,從而保證産品質量安全。該《辦法》對拟在中(zhōng)國境内生(shēng)産并銷售特醫食品和拟向中(zhōng)國出口特醫食品的境外(wài)生(shēng)産企業,從申請條件、注冊程序、臨床試驗、标簽與說明書(shū)、監督管理、法律責任等方面作出規定。以下(xià)總結了修訂後《辦法》中(zhōng)的重點變化。
一(yī)、制定優先審評審批程序,優化注冊流程
修訂後的《辦法》制定了優先審評審批程序,将罕見病、臨床急需新類型特醫食品納入優先審評審批程序,引導鼓勵企業研發臨床急需産品,滿足臨床病患需要。并将納入優先審評審批程序的産品,審評時限由最多的90個工(gōng)作日縮短到30個工(gōng)作日。在特定全營養配方食品在臨床試驗現場核查時限上進行了壓縮,由40個工(gōng)作日壓縮至30個工(gōng)作日,提高了審評時效。
修訂後的《辦法》優化了注冊中(zhōng)的現場核查流程,給予企業30個工(gōng)作日反饋是否接受現場核查,并明确具體(tǐ)核查時間,兼顧核查準備和工(gōng)作時效。
二、嚴格注冊要求,明确不予注冊的情形
修訂後的《辦法》明确了不予注冊的7種情形。分(fēn)别爲:(一(yī))申請材料弄虛作假、不真實的;(二)申請材料不支持産品安全性、營養充足性以及特殊醫學用途臨床效果的;(三)申請人不具備與所申請注冊産品相适應的研發能力、生(shēng)産能力或者檢驗能力的;(四)申請人未在規定時限内提交補正材料,或者提交的補正材料不符合要求的;(五)逾期不能确認現場核查日期,拒絕或者不配合現場核查、抽樣檢驗的;(六)現場核查報告結論或者樣品檢驗報告結論爲不符合注冊要求的;(七)其他不符合法律、法規、規章、食品安全國家标準和技術要求等注冊要求的情形。
同時,還明确要求不予注冊通知(zhī)要給出不予注冊的理由。現場核查内容的要求也進行了細化,并規定在注冊證書(shū)中(zhōng)增加“産品其他技術要求”項目,進一(yī)步保障産品質量安全有效。此外(wài),在違規行爲的處置力度上也進行了加嚴加大(dà)。
三、進一(yī)步明确産品标簽、說明書(shū)标示要求,保護消費(fèi)者權益
修訂後的《辦法》對标簽、說明書(shū)标示要求也進行了進一(yī)步的嚴格,該要求與《特殊醫學用途配方食品标識指南(nán)》以及GB 29922《食品安全國家标準 特殊醫學用途配方食品通則》的要求相結合,明确标簽的主要展示版面标注内容;要求對産品的配方特點或營養學特征進行描述;體(tǐ)現特醫食品産品屬性;在标簽、說明書(shū)上提示消費(fèi)者“請在醫生(shēng)或臨床營養師指導下(xià)使用”和警示用語,指導消費(fèi)者正确使用;明确不得對産品中(zhōng)的營養素及其他成分(fēn)進行功能聲稱,避免誤導消費(fèi)者。
四、對變更注冊和延續注冊的要求進行了調整
變更注冊需要提交産品變更論證報告,明确食品原料和食品添加劑品種不變、配料表順序不變、營養成分(fēn)表不變,使用量在一(yī)定範圍内合理波動或者調整的,不需要申請變更注冊。
延續注冊需要提交企業研發能力、生(shēng)産能力、檢驗能力情況,産品安全性、營養充足性和特殊醫學臨床效果方面的跟蹤評價情況等材料;要求省級食品安全監督管理部門出具延續注冊意見書(shū)。對于申請人未能保持研發能力、生(shēng)産能力、檢驗能力的不予延續注冊。
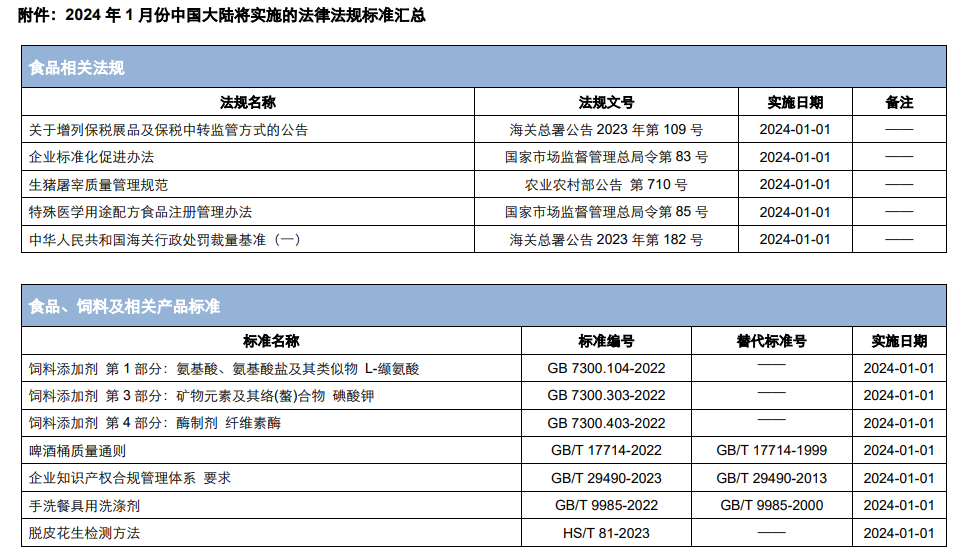
除上述法規外(wài),医脉经纬(北京)管理咨询有限公司還梳理彙總了1月正式實施的食品及飼料相關法規、國家标準等法規标準。詳細内容請見附件。
 京公網安備11010502045875
京公網安備11010502045875