依據《中(zhōng)華人民共和國食品安全法》要求,嬰幼兒配方乳粉的産品配方應當經國務院食品藥品監督管理部門注冊。《嬰幼兒配方乳粉産品配方注冊管理辦法》(以下(xià)簡稱“辦法”)已于2016年10月1日起施行,自2018年1月1日起,在我(wǒ)國境内生(shēng)産或向我(wǒ)國境内出口的嬰幼兒配方乳粉應當依法取得嬰幼兒配方乳粉産品配方注冊證。
國家市場監督管理總局負責嬰幼兒配方乳粉産品配方注冊管理工(gōng)作,國家市場監督管理總局食品審評中(zhōng)心負責嬰幼兒配方乳粉産品配方注冊申請的受理、審評工(gōng)作。
嬰幼兒配方乳粉是指符合相關法律法規和食品安全國家标準要求,以乳類及乳蛋白(bái)制品爲主要原料,加入适量的維生(shēng)素、礦物(wù)質和(或)其他成分(fēn),僅用物(wù)理方法生(shēng)産加工(gōng)制成的粉狀産品,适用于正常嬰幼兒食用。截止目前,嬰幼兒配方液态乳及以大(dà)豆及大(dà)豆蛋白(bái)制品爲主要原料的嬰幼兒配方食品不需要進行配方注冊。
嬰幼兒配方乳粉注冊申請人應當爲拟在中(zhōng)華人民共和國境内生(shēng)産并銷售嬰幼兒配方乳粉的生(shēng)産企業或者拟向中(zhōng)華人民共和國出口嬰幼兒配方乳粉的境外(wài)生(shēng)産企業。每個企業原則上不得超過3個配方系列9種産品配方,每個配方系列包括嬰兒配方乳粉(0—6月齡,1段)、較大(dà)嬰兒配方乳粉(6—12月齡,2段)、幼兒配方乳粉(12—36月齡,3段)。
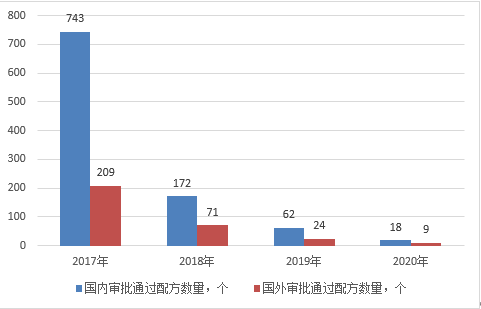
截止2020年4月,國家市場監督管理總局共批準168家企業的1308個配方注冊申請,目前有9個國産配方已注銷,有效配方爲1299個。其中(zhōng),已批準境内企業115家共計995個配方(包括已注銷的9個配方),已批準境外(wài)企業51家313個配方。
申請人在到受理大(dà)廳提交紙(zhǐ)質版的申請材料之前,應先完成電(diàn)子申請程序:
申請人通過國家市場監督管理總局或總局食品審評機構網站進入嬰幼兒配方乳粉産品配方注冊申請系統,按規定格式和内容填寫并打印申請書(shū)。
1.申請材料清單
(1)嬰幼兒配方乳粉産品配方注冊申請書(shū);
(2)申請人主體(tǐ)資(zī)質證明文件;
(3)原輔料的質量安全标準;
(4)産品配方;
(5)産品配方研發論證報告;
(6)生(shēng)産工(gōng)藝說明;
(7)産品檢驗報告;
(8)研發能力、生(shēng)産能力、檢驗能力的證明材料;
(9)标簽和說明書(shū)樣稿及其聲稱的說明、證明材料。
2.申請材料一(yī)般要求
(1)申請材料使用A4規格紙(zhǐ)張打印(中(zhōng)文不得小(xiǎo)于宋體(tǐ)小(xiǎo)四号字,英文不得小(xiǎo)于12号字),内容應完整、清楚,不得塗改。
(2)申請人應當同時提交申請材料的原件1份、複印件5份和電(diàn)子版本;審評過程中(zhōng)需要申請人補正材料的,應提供補正材料原件1份、複印件4份和電(diàn)子版本。
3.對申報資(zī)料的具體(tǐ)要求
(1)除注冊申請書(shū)和檢驗機構出具的檢驗報告外(wài),申請材料應逐頁或騎縫加蓋申請人公章或印章,境外(wài)申請人無公章或印章的,應加蓋駐中(zhōng)國代表機構或境内代理機構公章或印章,公章或印章應加蓋在文字處。
(2)申請材料中(zhōng)填寫的申請人名稱、地址、法定代表人等内容應當與申請人主體(tǐ)資(zī)質證明文件中(zhōng)相關信息一(yī)緻,申請材料中(zhōng)同一(yī)内容(如申請人名稱、地址、産品名稱等)的填寫應前後一(yī)緻。加蓋的公章或印章應與申請人名稱一(yī)緻(駐中(zhōng)國代表機構或境内代理機構除外(wài))。
(3)申請人主體(tǐ)資(zī)質證明材料、原輔料的質量安全标準、産品配方、生(shēng)産工(gōng)藝、檢驗報告、标簽和說明書(shū)樣稿及有關證明文件等申請材料中(zhōng)的外(wài)文,均應譯爲規範的中(zhōng)文;外(wài)文參考文獻(技術文件)中(zhōng)的摘要、關鍵詞及與配方科學性、安全性有關部分(fēn)的内容應譯爲規範的中(zhōng)文(外(wài)國人名、地址除外(wài)),外(wài)文資(zī)料附後。申請人應當确保譯本的真實性、準确性與一(yī)緻性。
注冊申報成功後,取得《嬰幼兒配方乳粉産品配方注冊證書(shū)》,有效期爲5年。
有效期滿,需要繼續使用原嬰幼兒配方乳粉産品配方的,申請人應當在行政許可批件期屆滿6個月前申請延續注冊。
有效期内,需要變更注冊證書(shū)及其附件載明事項的,申請人應當向國家市場監管總局提出變更注冊申請。
嬰幼兒配方乳粉産品配方的注冊過程較爲複雜(zá),審批周期相對較長,注冊過程中(zhōng)需提供的注冊材料和補正材料等均有嚴格的要求,對生(shēng)産企業來說需要有專門的團隊或人員(yuán)配合,生(shēng)産企業需提前做好充分(fēn)準備,2020年首批通過注冊的進口嬰幼兒配方乳粉萌締愛和伴寶樂系列由医脉经纬(北京)管理咨询有限公司全程代理注冊,医脉经纬(北京)管理咨询有限公司可提供嬰配配方注冊、标準法規咨詢、食品标簽審核等咨詢服務,有任何問題歡迎随時聯系我(wǒ)們(010-51301566)。
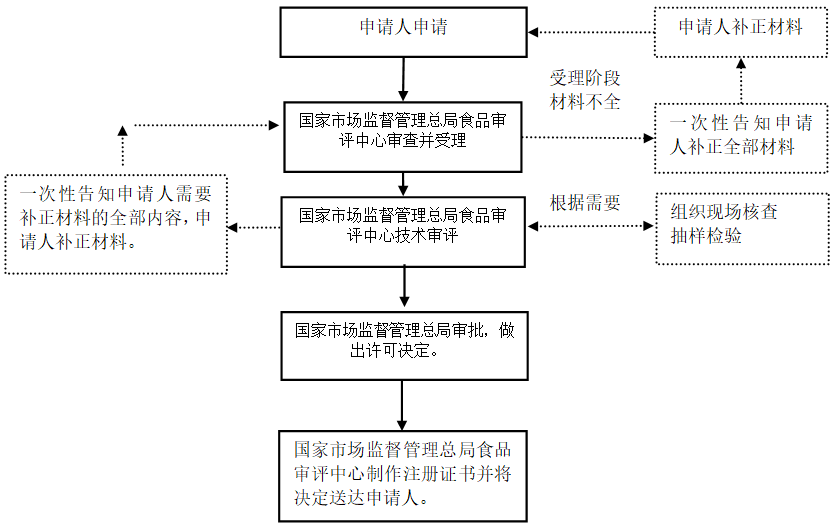
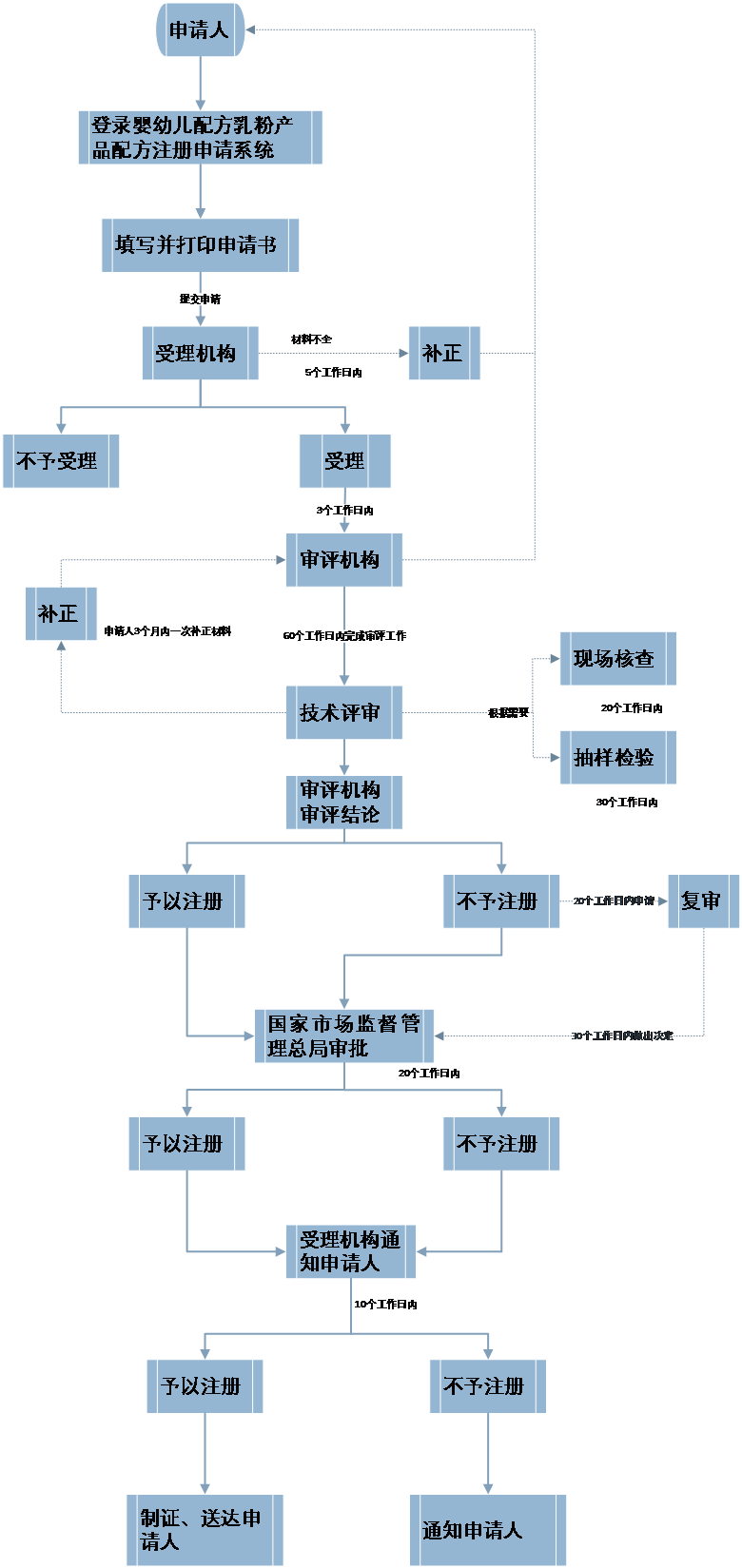
附錄1:注冊申請流程圖
注:對于申請進口嬰幼兒配方乳粉産品配方注冊的,審評機構将根據實際情況确定境外(wài)現場核查和抽樣檢驗時限。
附錄2:涉及相關法規及标準
《中(zhōng)華人民共和國食品安全法》
《嬰幼兒配方乳粉産品配方注冊管理辦法》
《嬰幼兒配方乳粉産品配方注冊标簽規範技術指導原則(試行)》
《嬰幼兒配方乳粉産品配方注冊申請材料項目與要求(試行)(2017修訂版)》
《嬰幼兒配方乳粉産品配方注冊審批服務指南(nán)》
《食品安全國家标準 嬰兒配方食品》GB 10765-2010
《食品安全國家标準 較大(dà)嬰兒和幼兒配方食品》GB 10767-2010










 京公網安備11010502045875
京公網安備11010502045875